 Ишемическая болезнь сердца, называемая также коронарной болезнью сердца, это наиболее частое осложнение сахарного диабета. Около половины диабетиков страдают ИБС, а 1/3 людей, больных ей, в свою очередь, болеют диабетом.
Ишемическая болезнь сердца, называемая также коронарной болезнью сердца, это наиболее частое осложнение сахарного диабета. Около половины диабетиков страдают ИБС, а 1/3 людей, больных ей, в свою очередь, болеют диабетом.
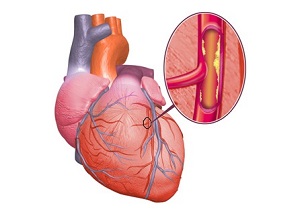
Однако можно избежать и задержать развитие ишемической болезни сердца. Коронарная болезнь это заболевание, при котором к сердечной мышце не доходит достаточного количества крови.
Так происходит из-за того, что в результате атеросклероза артерии, доставляющие кровь к сердцу, сужаются и блокируются. Эти артерии называются коронарными.
В результате кровь, а вместе с ней кислород и другие питательные вещества, не могут попасть к сердечной мышце, а она не может правильно выполнять свою работу.
Сахарный диабет ухудшает эту ситуацию. По причине инсулинорезистентности клетки сердечной мышцы не получают столько питательных веществ, сколько им требуется. Поэтому при ИБС и диабете сердце страдает от двойной нехватки питания, из-за чего ему тяжелее выполнять свою работу.
Сахарный диабет и ишемическая болезнь сердца: неразгаданная тайна сульфаниламидов
Стремительный рост числа больных сахарным диабетом, преобладание среди них пациентов с заболеванием типа 2, большинство из которых погибает от сердечно-сосудистых осложнений, – все это превращает проблему коронарного атеросклероза у больных диабетом в одну из актуальнейших проблем общественного здравоохранения.
Ожидается, что в ближайшем будущем сочетание ишемической болезни сердца (ИБС) и сахарного диабета будет встречаться значительно чаще, чем в настоящее время. Этому способствуют многие факторы:
- рост числа пожилых людей в индустриально развитых обществах с их высоким риском развития сахарного диабета и ИБС;
- увеличение продолжительности жизни больных сахарным диабетом типа 1, у которых риск развития ИБС возрастает с каждым дополнительным годом жизни;
- рост доли женского населения, среди которого сочетание сахарного диабета и ИБС встречается особенно часто;
- изменение среди населения развитых стран процентного содержания выходцев из Азии, особенно склонных к развитию сахарного диабета, и внедрение в медицинскую практику новых, более чувствительных критериев диагностики сахарного диабета, которые приведут к большей выявляемости этого заболевания.
Все эти факторы приведут к абсолютному увеличению числа больных, которым потребуются медицинские вмешательства для предотвращения сердечно-сосудистых осложнений сахарного диабета.
При стенокардии и инфаркте миокарда смертность больных сахарным диабетом типа 2 в 2–4 раза превышает соответствующий показатель у лиц общей популяции. Особенно часто летальный исход наступает при явлениях застойной сердечной недостаточности. Не менее 35–75% сосудистых осложнений при сахарном диабете провоцируется присоединением артериальной гипертонии. В настоящее время известно, что борьба с артериальной гипертонией является одним из наиболее эффективных средств снижения осложнений ИБС у больных сахарным диабетом.
При одном и том же количестве традиционных факторов риска смертность от ИБС у больных сахарным диабетом значительно выше.
Большое значение в развитии раннего коронарного склероза имеют специфические нарушения липидного обмена у больных сахарным диабетом типа 2, которые носят название “диабетической дислипидемии”. Атерогенное действие дислипидемии драматически усиливается при присоединении диабетических нарушений углеводного обмена.
Влияние повышения уровня глюкозы в крови на риск развития ИБС обнаружено во многих проспективных исследованиях. Их результаты показали, что у лиц с высоким уровнем тощаковой и постнагрузочной глюкозы отмечается достоверно более высокая смертность от сердечно-сосудистых заболеваний.
Убедительные эпидемиологические данные свидетельствуют о существовании достоверной связи между уровнем гликозилированного гемоглобина Alc и риском сердечно-сосудистой заболеваемости и смертности. При увеличении уровня гликозилированного гемоглобина на 1% риск развития сердечно-сосудистых заболеваний возрастает на 10%.
Длительное наблюдение за влиянием интенсивной антидиабетической терапии на частоту развития сосудистых осложнений у больных диабетом типа 2 привело исследователей Великобритании к заключению, что ни один из способов коррекции углеводного обмена (инсулин, сульфаниламиды или бигуаниды) не обладает достоверным преимуществом перед другими.
При их адекватном использовании частота возникновения инфаркта миокарда у больных сахарным диабетом типа 2 снижалась в среднем на 16%, p=0,052. Ни при одном из видов лечения не наблюдалось ухудшения сердечно-сосудистого прогноза. Это заключение исследователей относится и к применению препаратов сульфанилмочевины, относительно сердечно-сосудистых эффектов которых мнения предыдущих исследователей были весьма неоднозначны.
В то же время эту группу препаратов получают не менее 50% всех больных сахарным диабетом типа 2, принимающих пероральные гипогликемические средства. Поэтому ответ на вопрос об их воздействии на сердечно-сосудистый прогноз больных диабетом влечет за собой огромные медицинские и социально-экономические последствия.
Безопасность применения сульфаниламидов у больных сахарным диабетом стала обсуждаться с начала 1970-x годов, после публикации результатов исследования, проведенного в 12 университетских центрах США (UGDP) и посвященного оценке эффективности пероральных гипогликемических средств в предотвращении сосудистых осложнений сахарного диабета.
Целью исследования, которое продолжалось с 1961 по 1969 г., являлась оценка возможного влияния сахароснижающей терапии инсулином и таблетированными препаратами на сосудистые осложнения при лечении сахарного диабета типа 2.
В исследование вошли 823 пациента, которые были распределены по четырем группам: плацебо (монодиетотерапия); толбутамид (препарат сульфанилмочевины) в дозе 1,5 г в сутки+диета; традиционная инсулинотерапия (10–16 ед. в сутки)+диета; интенсифицированная инсулинотерапия+диета.
Не было найдено каких-либо достоверных различий между группами в отношении нефатальных осложнений диабета. Группы не различались по общему количеству инфарктов миокарда. Однако в группе пациентов, принимавших толбутамид, отмечена более высокая смертность в результате инфаркта миокарда, чем в группе больных, получавших плацебо (50 и 18% соответственно).
Было признано не этичным продолжать в этих условиях дальнейшее исследование, оно было прекращено комитетом наблюдателей. Преждевременное окончание работы не дало возможности сделать однозначный вывод об увеличении общей смертности при приеме толбутамида.
Заключение Комитета тем не менее совпало с выводами UGPD о том, что использование толбутамида влечет за собой увеличение смертности от сердечно-сосудистых заболеваний. Обнаружилось также, что количество сердечно-сосудистых смертей было наибольшим среди тех пациентов, которые точно и сознательно придерживались предписанного лечения.
Результаты нескольких других ретроспективных исследований обнаружили отчетливо негативное или возможно негативное влияние и других средств сульфанилмочевины на сердечно-сосудистый прогноз больных сахарным диабетом.
До сих пор на упаковочных вкладышах всех препаратов сульфанилмочевины печатается предостережение о возможном повышении риска смерти от сердечно-сосудистых заболеваний при их применении.
Возможные причины влияния препаратов сульфанилмочевины на сердечно-сосудистый прогноз больных диабетом стали прояснятся в начале 90-х годов.
АТФ-зависимые калиевые каналы были открыты в 1983 г., тогда же было обнаружено свойство препаратов сульфанилмочевины по их блокированию.
Эти каналы были обнаружены во многих тканях организма, включая сердце и сосуды. Как оказалось, эти каналы играют значительную роль в физиологии сердечно-сосудистой системы. Обнаружено, что активизация, открытие этих каналов в миокарде предохраняет сердечную мышцу от развития некроза при повторных ишемических атаках и уменьшает негативные последствия стенокардии.
В гладкомышечных клетках сосудов открытие АТФ-зависимых калиевых каналов снижает сосудистый тонус. Активация этих каналов ведет к увеличению коронарного кровотока, уменьшает пред- и постнагрузку и увеличивает сердечный индекс, способствуя ликвидации недостаточности кровообращения. При активации АТФ-зависимых калиевых каналов наблюдается снижение системного артериального давления.
В 1986 г. был описан феномен метаболической адаптации миокарда к транзиторной ишемии. Этот феномен, названный термином “прекондиционирование”, представляет собой защитный механизм метаболической адаптации миокарда, который включается во время одного или нескольких коротких эпизодов ишемии и предохраняет миокард от повреждения во время последующих приступов. Через несколько лет стало ясно, что ключевым моментом в метаболической адаптации миокарда к ишемии является активация АТФ-зависимых калиевых каналов.
Исследования последних лет установили, что АТФ-зависимые калиевые каналы состоят из четырех комплексов, каждый из которых состоит из двух различных белковых субъединиц. Одна субъединица формирует поры (Kir6,2), вторая является регуляторной, обладающей способностью связываться с препаратами сульфанилмочевины (SUR).
АТФ-зависимые калиевые каналы в различных тканях имеют обычно одинаковые субъединицы Kir6.2 и различные типы субъединиц SUR. Калиевые каналы бета-клеток поджелудочной железы состоят из Kir6.2 и SUR1, каналы в миоцитах – из Kir6.2 и SUR2A, каналы в гладкомышечных клетках сосудов – из Kir6.2 и SUR2B.
Все препараты сульфанилмочевины обладают способностью связываться с SUR1-субединицей бета-клеток, вызывая увеличение секреции инсулина.
Благодаря своему строению глибенкламид блокирует АТФ-зависимые калиевые каналы в миокарде, что заставляет опасаться его потенциально неблагоприятного воздействия на процессы метаболической адаптации миокарда к ишемии.
Экспериментальные исследования подтвердили, что прием этого препарата снижает метаболические возможности ограничения зоны инфаркта миокарда. Обнаружено, что высокие дозы глибенкламида, введенные интракоронарно, могут снижать коронарный кровоток.
Обнаружены и благоприятные эффекты глибенкламида в отношении сердечно-сосудистой системы. Глибенкламид оказывает антиаритмическое действие, способствуя снижению внезапной смерти. Антиаритмический эффект глибенкламида хорошо объясняется блокированием калиевых каналов миокарда, препятствующим укорочению потенциала действия в миокардиальной клетке, возникающего при открытых калиевых каналах.
Концепция о том, что современные препараты сульфанилмочевины могут быть потенциально опасны, подтверждается данными, основанными на сравнении отдаленных результатов коронарного шунтирования и чрескожной коронарной ангиопластики у больных сахарным диабетом. В этих исследованиях выживаемость больных после шунтирования была выше, чем после ангиопластики.
Особенно отчетливо неблагоприятный эффект ангиопластики был заметен в группе лиц, леченных препаратами сульфанилмочевины. Фактически двумя важнейшими факторами, независимо связанными с плохим исходом ангиопластики, были неполноценная реваскуляризация миокарда и прием препаратов сульфанилмочевины.
Открытие существования этих каналов, выяснение их роли в гипогликемическом эффекте препаратов сульфанилмочевины и появление представлений о значении этих каналов в механизмах метаболической адаптации миокарда к ишемии – все это вновь подхлестнуло интерес к данным UGPD. Теперь эти результаты не кажутся случайными, относящимися только к одному толбутамиду. Это заставляет проводить поиск наиболее “безопасных” сульфаниламидов.
Интенсивные работы привели к тому, что теперь врачи располагают препаратами сульфанилмочевины, избирательно связывающимися с АТФ-зависимыми каналами бета-клеток поджелудочной железы и не влияющими на активность подобных каналов в клетках миокарда. В первую очередь к таким препаратам относится гликлазид. Уже сейчас показано, что препарат оказывает благоприятное воздействие на многие факторы, связанные с риском развития и смерти от ИБС.
Гликлазид в отличие от глибенкламида снижает агрегацию тромбоцитов, повышает активность тканевого активатора плазминогена и прекаликреина, препятствуя повышенному тромбообразованию у больных сахарным диабетом.
Снижение под его влиянием окислительного стресса, уменьшение выработки молекул адгезии, уменьшение выработки проатерогенного a-фактора некроза опухоли – все это способствует стабилизации атерогенных “бляшек-убийц” в сосудистой стенке и снижает риск развития инфаркта миокарда и недостаточности кровообращения у больных сахарным диабетом.
Недавно опубликованные данные проспективного изучения диабета в Великобритании безусловно, уменьшили опасения относительно возможных нежелательных эффектов используемых в практике препаратов сульфанилмочевины. В нем не было обнаружено различий в результатах лечения при применении инсулина, сульфаниламидов или бигуанидов.
Возможной причиной того, что UKPDS не выявило негативного воздействия производных сульфанилмочевины на сердечно-сосудистую систему, явилось то, что соматически тяжелые и пожилые пациенты не были включены в данное исследование. Кроме того, необходимо отметить, что раздельного анализа влияния глибенкламида на больных с ИБС и без ИБС проведено не было.
Ответ на вопрос о роли препаратов сульфанилмочевины в профилактике макро- и микрососудистых осложнений у больных сахарным диабетом типа 2, как ожидается, будет получен в результате проведения исследования ADVANCE, которое окончится в 2004–2005 гг. Это исследование охватит 10 000 больных сахарным диабетом, которые будут подвергнуты интенсивному лечению гликлазидом и интенсивной гипотензивной терапии. Исследование продлится в среднем 4,5 года, его результаты внесут значительный вклад в последующую клиническую практику диабетологов и кардиологов.
На основе сегодняшних знаний можно считать, что производные сульфанилмочевины могут свободно использоваться в лечении больных сахарным диабетом типа 2, не вызывая серьезных осложнений со стороны сердечно-сосудистой системы.
Имеются обоснованные данные о том, что у лиц с наличием ИБС, особенно при ее осложненном течении, предпочтительнее применять препараты сульфанилмочевины с минимальными кардиальными эффектами.
Источник: http://con-med.ru
Лечение ишемической болезни сердца у больных сахарным диабетом 2 типа
Согласно данным, опубликованным в 1995 г., сахарным диабетом (СД) страдают около 4% (135 миллионов) жителей планеты, а к 2025 г. его распространенность предположительно возрастет на 5,4%, что означает более чем двукратное увеличение (до 300 миллионов) количества больных с этим заболеванием . Среди них 90% больных с СД 2 типа.
Сердечно–сосудистые заболевания, в особенности ишемическая болезнь сердца (ИБС), являются основной причиной смерти больных СД. Относительный риск ее возникновения повышен у мужчин в зависимости от возраста в 1,5–2,5 раза, у женщин – в 1,7–4 раза, а увеличение риска всегда более выражено у женщин в сравнении с мужчинами. Наличие СД сопряжено с повышенным риском возникновения всех форм ИБС, включая стенокардию, безболевую ишемию миокарда, инфаркт миокарда, а также внезапную сердечную смерть.
Принимая во внимание тесную связь между сердечно–сосудистой патологией и СД, последний, с точки зрения сердечно–сосудистой медицины, следует рассматривать, по мнению AHA, как сердечно–сосудистое заболевание.
Причины возникновения ИБС у больных СД 2 типа
Точные причины ускоренного развития коронарного атеросклероза у больных СД 2 типа остаются не выясненными. С одной стороны, СД 2 типа, как у мужчин, так и у женщин, представляет собой важный и независимый фактор риска заболеваний, обусловленных атеросклеротическим поражением сосудистого русла.
С другой стороны, показана тесная связь между СД 2 типа и другими факторами риска ИБС, как общепризнанными, так и теми, прогностическая значимость которых пока не установлена. По данным Фрамингемского исследования, традиционные факторы риска ИБС у больных СД обнаруживают в 1,4–4,1 раза чаще, чем у населения, не имеющего этого заболевания.
Для больных СД 2 типа характерно наличие количественных и качественных изменений липопротеидов крови. Из количественных изменений выделяют гипертриглицеридемию и уменьшение холестерина липопротеидов высокой плотности (ХС ЛПВП), обнаруживаемых приблизительно у 20% больных.
Уровень ХС липопротеидов низкой плотности (ЛПНП) у больных СД 2 типа и среди населения, его не имеющего, как правило, является идентичным [10,12]. Увеличение ХС ЛПНП у больных СД 2 типа обусловлено, по–видимому, генетическими причинами и не связано непосредственно с его наличием.
Из структурных изменений липопротеидов у больных СД 2 типа выделяют гиперпродукцию малых плотных ЛПНП. Изменение структуры липопротеидов также возникает в результате перекисного окисления входящих в их состав липидов и неферментативного гликирования аполипопротеинов. Подобные изменения могут приводить к возникновению атеросклероза в отсутствие количественных изменений липопротеидов.
Артериальную гипертонию обнаруживают у 20–60% больных СД 2 типа. Артериальная гипертония у них встречается в 1,5 раза чаще, чем у населения без СД. Пациенты с СД и артериальной гипертонией имеют в 2 раза более высокий риск возникновения сердечно–сосудистых заболеваний, чем больные с артериальной гипертонией, но без СД.
Наличие артериальной гипертонии у больных СД сопровождается увеличением риска развития не только макроваскулярных, но и микроваскулярных осложнений, таких как нефропатия и ретинопатия.
Возникновение ИБС у больных СД 2 типа может быть связано с отклонениями в системе гемостаза. Для этого заболевания характерны: нарушение функции тромбоцитов, повышение уровня ряда факторов свертывающей системы крови (фибриногена, VII фактора, VIII фактора, фактора Виллебранда), уменьшение активности ингибиторов свертывания (антитромбина и протеина С), повышение уровня ингибитора активаторов плазминогена 1 типа, являющегося ингибитором фибринолиза.
Повреждение эндотелия и его дисфункция играют важную роль в процессе атерогенеза. В экспериментальных и клинических исследованиях были получены многочисленные свидетельства о наличии эндотелиальной дисфункции у больных СД 2 типа.
Выраженные нарушения функции эндотелия могут отчасти являться причиной повышенного риска возникновения ИБС у этой категории пациентов. Следует, однако, отметить, что прогностическая значимость показателей, используемых в настоящее время для оценки функции эндотелия, остается малоизученной.
Совокупности факторов риска, сопутствующих инсулинорезистентности, был присвоен термин «синдрома Х». Связь между инсулинорезистентностью и факторами риска ИБС была показана во многих исследованиях. Инсулиноризестентность и обусловленные ею изменения предшествуют клиническим проявлениям СД, а наличие таковых отклонений у больного свидетельствует о высоком риске возникновения ИБС.
Особенности лечения и профилактики ИБС у больных СД
Рекомендации, касающиеся лечения и профилактики ИБС у больных СД 2 типа, основаны, как правило, на результатах клинических исследований у пациентов без СД. Больные СД в эти исследования часто не были включены или представлены малым количеством.
В тех случаях, когда их число было достаточным для проведения подгруппового анализа, получены свидетельства о возможности вторичной профилактики ИБС у пациентов с СД с помощью медикаментозной коррекции нарушений липидного обмена и уровня артериального давления (АД), посредством назначения дезагрегантов, b-адреноблокаторов, а также ингибиторов ангиотензинпревращающего фермента (АПФ).
Лечение дислипидемии
Рекомендации American Diabetes Association (ADA), касающиеся лечения дислипидемии у больных СД, в основном соответствуют рекомендациям экспертной комиссии National Cholesterol Education Program (NCEP), по мнению которой лечение дислипидемии у пациентов с СД следует осуществлять в соответствии с теми же принципами, как у больных с ИБС.
Приоритетной задачей является нормализация ХС ЛПНП, а из препаратов, которые могут быть использованы для его снижения, статины следует считать препаратами первого выбора. Целью лечения является достижение уровня ХС ЛПНП <2,6 ммоль/л (100 мг/дл). При ХС ЛПНП, равном или превышающем это значение, показано назначение лечебной диеты. Соблюдение строгой диеты позволяет снизить ХС ЛПНП на 0,4–0,65 ммоль/л (15–25 мг/дл).
Второй по значимости задачей лечения дислипидемии у больных СД 2 типа является коррекция ХС ЛПВП. Оптимальным считают уровень ХС ЛПВП >40 мг/дл (1,02 ммоль/л) у мужчин и >50 мг/дл (1,28 ммоль/л) – у женщин. Связь между содержанием ХС ЛПВП и контролем гликемии отсутствует или является низкой.
Потеря веса, прекращение курения и повышение физической активности способствуют росту ХС ЛПВП. Увеличение уровня ХС ЛПВП может быть достигнуто с помощью терапии никотиновой кислотой (при тщательном контроле углеводного обмена) или фибратами.
Уменьшение ТГ является третьей по значимости задачей лечения дислипидемии у больных СД 2 типа. Цель лечения состоит в достижении концентрации ТГ <150 мг/дл (1,7 ммоль/л). Первым шагом в коррекции ТГ следует считать контроль гликемии; однако ТГ часто остаются повышенными, несмотря на уменьшение уровня глюкозы крови. Падению ТГ способствует снижение веса и уменьшение употребления алкоголя. При отсутствии достаточного эффекта от этих мер рекомендовано проведение терапии фибратами.
Коррекцию уровня липидов у больных СД 2 типа со смешанной ГЛП следует осуществлять согласно рекомендациям ADA, прежде всего высокими дозами статинов и при контроле гликемии.
В том случае, когда подобная тактика не позволяет добиться желаемого эффекта, может быть рассмотрено назначение комбинированной гиполипидемической терапии статинами и фибратами (за исключением гемфиброзила, так как его совместный прием со статинами сопряжен с повышенным риском развития рабдомиолиза). В третью очередь, рекомендовано использование комбинации фибратов с секвестрантами желчных кислот или статинов с никотиновой кислотой.
Ведущая роль статинов в лечении дислипидемий обусловлена результатами исследований, в которых было показано уменьшение смертности и заболеваемости от ИБС при приеме препаратов этой группы. Получены доказательства эффективности статинов как с целью вторичной, так и первичной профилактики ИБС.
Статины в сравнении с гиполипидемическими препаратами других групп позволяют наиболее результативно снижать уровень ХС ЛПНП. Доказательства положительного влияния гиполипидемической терапии статинами на прогноз больных СД 2 типа впервые были получены в исследованиях Scandinavian Simvastatin Survival Study (4S), Cholesterol and Recurrent Events (CARE) Trial и Long–term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study.
Фибраты особенно эффективны в уменьшении уровня ТГ и в увеличении ХС ЛПВП, но в меньшей, чем статины, степени снижают ХС ЛПНП. В связи с этим коррекцию ТГ и ХС ЛПВП у больных СД 2 типа, имеющих нормальный уровень ХС ЛПНП, можно осуществлять с помощью фибратов.
Благоприятное влияние фибратов на прогноз больных СД 2 типа и замедление у них прогрессирования коронарного атеросклероза было показано в исследованиях Diabetes Atherosclerosis Intervention Study (DAIS) и Veterans Affairs High–Density Lipoprotein Cholesterol Intervention Trial (VA HIT).
Кроме того, прием никотиновой кислоты может сопровождаться нежелательным повышением уровня мочевой кислоты. Секвестранты желчных кислот обладают способностью повышать уровень ТГ. Они менее эффективны, чем статины, в снижении ХС ЛПНП. В связи с этим секвестранты желчных кислот играют второстепенную роль в коррекции дислипидемий у пациентов с СД 2 типа.
Лечение артериальной гипертонии
Данные клинических исследований, проведенных в последнее десятилетие, показали эффективность гипотензивной терапии в профилактике сердечно–сосудистых заболеваний, в том числе ИБС, у больных СД 2 типа. У них в сравнении с пациентами без СД к лечению артериальной гипертонии требуется более агрессивный подход.
Согласно последним рекомендациям Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure, артериальную гипертонию следует диагностировать при более низком, чем у больных без СД, уровне артериального давления (АД), равном 130/85 мм рт.ст., и сразу же назначать гипотензивную терапию.
Имеющиеся в настоящий момент сведения не позволяют делать категоричных утверждений о преимуществе в лечении пациентов с СД 2 типа гипотензивных препаратов какой–либо одной лекарственной группы. Тем не менее, с учетом многочисленных свидетельств о положительном влиянии ингибиторов АПФ на течение макро– и микроангиопатии, их следует считать препаратами первого выбора.
Эта рекомендация в особенности правомерна для больных с микроальбуминурией или протеинурией. У них в качестве препаратов первого выбора могут рассматриваться также антагонисты рецепторов к ангиотензину II.
Лечение артериальной гипертонии у пациентов с СД 2 типа можно начинать с помощью b-адреноблокаторов или мочегонных, в то время как антагонисты кальция следует считать препаратами второго выбора. Для достижения необходимого уровня АД у многих больных может потребоваться назначение 3–х и более препаратов.
Ацетилсалициловая кислота
Согласно рекомендациям ADA, назначение ацетилсалициловой кислоты показано всем больным СД 2 типа с целью вторичной профилактики ИБС при отсутствии к нему противопоказаний. Назначение ацетилсалициловой кислоты с целью первичной профилактики ИБС показано пациентам с СД 2 типа в возрасте >30 лет, имеющим высокий риск ее возникновения (с неблагоприятной наследственностью в отношении ИБС, курящим, с артериальной гипертонией, выраженным ожирением, альбуминурией, дислипидемией).
Прием ацетилсалициловой кислоты больными СД, вошедшими в эти исследования, сопровождался уменьшением на 17% риска развития серьезных сердечно–сосудистых осложнений (инфаркт миокарда, инсульт, летальный исход, обусловленный сердечно–сосудистыми заболеваниями), что достоверно не отличалось от пациентов без СД, где снижение риска составило 22%.
Ацетилсалициловую кислоту следует назначать в суточной дозе 75–325 мг. Помимо риска кровотечений, который повышен особенно у пожилых пациентов, основной клинической сложностью являются побочные эффекты со стороны ЖКТ. Долгое время единственным решением проблемы считали применение кишечно–растворимых форм АСК.
Однако результаты многоцентровых исследований показали, что эрозии и язвы желудка образуются даже при применении таких препаратов. Кроме того в последние годы пристальное внимание врачей привлекает НПВП–вызванная энтеропатия, которая часто приводит к развитию синдрома мальабсорбции, стенозов и стриктур кишечника.
Применение препаратов АСК с кишечно–растроворимой оболочки может спровоцировать поражение кишечника, т.к. вся доза ацетилсалициловой кислоты приходится именно на этот отдел ЖКТ. Поэтому в последнее время основным направлением развития безопасности препаратов АСК является создание комбинированных препаратов АСК и антацидов.
Такое сочетание позволяет всасываться АСК в «физиологических» отделах, начиная с желудка, а антацидный компонент является профилактикой язвообразования. Это происходит за счет снижения протеолитической активности желудочного сока, обволакивающего действия, цитопротективного действия – усиления секреции бикарбонатов, увеличения гликопротеидов желудочной слизи.
На сегодняшний день в России существует только один комбинированный препарат – Кардиомагнил, который представляет собой комбинацию АСК в дозах 75 мг и 150 мг (таблетки форте) и гидроксид магния. Доза антацида, входящего в состав Кардиомагнила, не влияет на всасываемость АСК, что подтверждено клиническими испытаниями.
При наличии аллергии к ацетилсалициловой кислоте может быть рекомендован прием клопидогрела 75 мг/сут. Ацетилсалициловая кислота противопоказана пациентам в возрасте <21 года в связи с повышенным риском развития у них синдрома Рейе.
b-адреноблокаторы
Назначение b-адреноблокаторов больным, перенесшим инфаркт миокарда, приводит к уменьшению смертности пациентов и риска возникновения у них повторного инфаркта. Тем не менее применение b-адреноблокаторов у больных СД в недавнем прошлом вызывало значительную настороженность из–за опасений усугубления метаболических расстройств и маскировки симптомов гипогликемии.
Первое свидетельство возможности положительного влияния b-адреноблокаторов на прогноз больных с инфарктом миокарда и сопутствующим СД было получено при проведении подгруппового анализа результатов исследования Norwegian Multicenter Study of Timolol after Myocardial Infarction.
Подгрупповой анализ результатов исследования Bezafibrate Infarction Prevention (BIP) выявил уменьшение на терапии b-адреноблокаторами смертности пациентов с хроническими формами ИБС и сопутствующим СД. С целью уменьшения риска возникновения побочных явлений при приеме препаратов данной группы лечение больных СД следует осуществлять с помощью кардиоселективных b-адреноблокаторов.
Ингибиторы АПФ
В больших рандомизированных исследованиях было выявлено, что длительный прием ингибиторов АПФ больными, перенесшими инфаркт миокарда и имеющими снижение фракции выброса левого желудочка, сопровождается уменьшением их смертности, а также вероятности развития застойной сердечной недостаточности и повторного инфаркта миокарда.
Благоприятное влияние ингибиторов АПФ на отдаленный прогноз больных СД с дисфункцией левого желудочка, обусловленной перенесенным инфарктом миокарда, показал подгрупповой анализ исследований, в которые были включены подобные пациенты.
Подобное действие препарата не было связано с его влиянием на АД. Оценка результатов исследования HOPE позволяет высказать предположение о необходимости назначения ингибиторов АПФ всем больным ИБС в сочетании с СД 2 типа.
Коррекция гликемии
Логично было бы предположить, что гипергликемия прямо или косвенно оказывает влияние на возникновение ИБС у больных СД. Однако убедительные доказательства о наличии связи между гипергликемией и повышенным риском развития ИБС отсутствуют.
По данным этой работы, проведение инсулинотерапии у больных инфарктом миокарда в сочетании с СД сопровождается уменьшением летальности пациентов в течение первого года от возникновения инфаркта. Строгий контроль гликемии у пациентов с СД 2 типа предотвращает развитие микроваскулярных осложнений.
Хирургическое лечение ИБС
Общепризнанным фактом является то, что наличие СД у больных ИБС сопряжено с повышенным риском возникновения рестеноза после проведения транслюминальной баллонной ангиопластики коронарных артерий (ТБКА).
Стентирование коронарных артерий и применение ингибиторов гликопротеиновых рецепторов IIb/IIIa уменьшает риск развития рестеноза и серьезных осложнений в последующем после проведения ТБКА периоде, но даже в этом случае он остается повышенным в сравнении с больными без СД.
Исследования последних лет показали значительное снижение вероятности развития рестеноза при использовании стентов, содержащих препараты, подавляющие пролиферацию сосудистых клеток. Однако исследований по применению подобных стентов у больных СД не проводилось.
Сведения, касающиеся влияния СД 2 типа на результаты коронарного шунтирования (КШ), носят ограниченный характер. Анализ данных позволяет сделать вывод о том, что наличие СД сопряжено с более плохим отдаленным прогнозом больных, перенесших КШ. Тем не менее проведение операции значительно улучшает их качество жизни.
Результаты исследований не позволяют сделать однозначное заключение о выраженном негативном влиянии СД на ранний прогноз. Периоперационная летальность больных гораздо в большей степени зависит от других факторов, таких как возраст, пол, указание на предшествующую операцию на сердце, фракция выброса левого желудочка, процент стеноза основного ствола левой коронарной артерии, количество основных магистральных коронарных артерий со стенозированием просвета >70%, экстренность проведения операции.
СД относят к факторам риска периоперационного медиастинита и инсульта, однако ни в первом, ни во втором случаях СД также не является основной предрасполагающей причиной . Уменьшение вероятности развития медиастинита может быть достигнуто посредством поддержания уровня глюкозы крови в раннем послеоперационном периоде с помощью постоянной инфузии инсулина. Сведения о сравнительном влиянии медикаментозной терапии и хирургического лечения ИБС на прогноз жизни больных СД отсутствуют.
Сравнительная оценка результатов КШ и ТБКА, проведенная в исследовании Bypass Angioplasty Revascu-larization Investigation (BARI), позволила сделать вывод о предпочтительности проведения шунтирования коронарных артерий у больных СД с многососудистыми поражениями коронарных артерий и находящихся на терапии пероральными гипогликемическими препаратами либо инсулином. Однако данные этого исследования не могут экстраполироваться на больных, которым осуществляется стентирование коронарных артерий.
Таким образом, профилактика ИБС у больных СД 2 типа в сравнении с больными, не имеющими СД, требует более агрессивного вмешательства и более жестких требований к коррекции дислипидемии и уровня АД. У пациентов с СД 2 типа показана возможность профилактики ИБС с помощью ацетилсалициловой кислоты, b-адреноблокаторов и ингибиторов АПФ.
Большинство больных ИБС в сочетании с СД не получают оптимального лечения. Не исключено, что подобная ситуация является одной из причин неблагоприятного прогноза больных СД.
Источник: http://www.rmj.ru
Вопросы диагностики, медикаментозного и хирургического лечения, прогноз
На сегодняшний день сахарным диабетом страдает 2,1% населения Земли, и в 97% случаев это сахарный диабет 2-го типа (СД 2). СД 2 развивается в результате снижения секреции инсулина b-клетками поджелудочной железы и снижения чувствительности периферических тканей к гормону (инсулинорезистентность).
Доля ССЗ в структуре смертности больных СД составляет 80%, поэтому следует подчеркнуть важность их ранней диагностики и агрессивного лечения. В ряде эпидемиологических исследований было показано, что у больных СД частота ССЗ увеличивается по мере роста гликемии.
Патогенез сердечно-сосудистых нарушений у больных СД
В настоящее время к «нетрадиционным» ФР ИБС у больных СД 2 относят уровень инсулинемии, малые размеры частиц ЛНП и количество аполипопротеина В, находящегося во всех фракциях липопротеинов, обогащенных триглицеридами. Влияние гипергликемии на атерогенез в сосудистой стенке реализуется через развитие генерализованной дисфункции эндотелия сосудов, усиление окислительного стресса и повышение концентрации конечных гликозилированных продуктов обмена.
Именно эти процессы при СД 2 резко усиливают адгезию моноцитов крови к сосудистому эндотелию с последующим проникновением их в сосудистую стенку. Процесс моноцитарно-эндотелиального взаимодействия является одним из главных пусковых механизмов формирования атеросклеротической бляшки и развития атеросклеротических поражений сосудистой стенки.
Внутри сосудистой стенки моноциты, накапливая липиды, превращаются в пенистые клетки, которые, выделяя активные биологические вещества, играют центральную роль в формировании атеромы. Особенно важна роль этих клеток в секреции провоспалительных медиаторов, под влиянием которых эндотелиальные клетки увеличивают выработку молекул адгезии, таких как Е-селектин, молекулы межклеточной адгезии I и молекулы адгезии I сосудистого эндотелия.
Эти молекулы еще более усиливают прилипание циркулирующих моноцитов к эндотелию и проникновение моноцитов в интиму сосудов. Повышенный уровень адгезии эндотелиальных клеток и повышенная адгезивность моноцитов к эндотелию характерны для больных СД 2. Таким образом, гипергликемия провоцирует возникновение первичных очагов атероматозного поражения сосудистой стенки и создает условия для специфического клеточного компонента этих атером.
Особое значение при СД 2 имеют нарушения липидного обмена, которые сохраняются у этих больных и после коррекции уровня глюкозы в крови. Эти нарушения получили название диабетической дислипидемии. Компонентами ее являются гипертриглицеридемия, снижение концентрации ХС ЛВП, увеличение процентного содержания малых плотных частиц ЛНП.
Липидная триада представляет собой специфический вариант атерогенной дислипопротеинемии, способствующей развитию атеросклероза, независимо от повышения уровней общего ХС и общей фракции ЛНП.
Липотоксичность и повышение уровня свободных жирных кислот (СЖК) в сочетании с гипергликемией и/или инсулинорезистентностью служат факторами риска (ФР) поражения сердца, т. к. СЖК и продукты их окисления оказывают прямое токсическое действие на миокард, что может вызывать развитие диабетической кардиомиопатии. Окисленные ЛНП токсичны для клеток эндотелия, поскольку они препятствуют вазодилатации через инактивацию оксида азота и вызывают разрушение эндотелия.
Они включают стенокардию, безболевую ишемию, инфаркт миокарда и сердечную недостаточность. При СД ИБС нередко носит безболевой характер, что затрудняет своевременную диагностику и начало лечения.
Поэтому у больных СД следует более активно применять скрининговые исследования в отношении ИБС, визуализирующие нагрузочные тесты (стресс-эхокардиография и радионуклидные методы), холтеровское суточное мониторирование ЭКГ, компьютерную томографию, особенно при сопутствующих ФР – гиперлипидемии, артериальной гипертонии (АГ), ожирении.
Коронарография занимает основное место в обследовании пациентов с ИБС, т. к. дает достоверную информацию о наличии или отсутствии стеноза просвета коронарных артерий, определяет возможности лечения (медикаментозное или операция реваскуляризации миокарда) и прогноз заболевания.
Имеются данные о том, что у таких пациентов развивается субклиническая дисфункция желудочков сердца, которая оказывает негативное влияние на переносимость физической нагрузки.
Лечение
Современные подходы к лечению больных СД предполагают физиологический контроль гликемии (снижение уровня гликозилированного (гликированного) гемоглобина до 6,5% и менее) и борьбу с другими ФР ИБС, такими как дислипидемия, АГ, ожирение, курение и нефропатия. В настоящее время убедительно доказано, что близкий к норме уровень гликемии снижает смертность и риск осложнений у больных СД 1 и 2.
Современное определение самоконтроля включает регулярное самостоятельное измерение уровня глюкозы в крови между визитами к врачу с помощью глюкометра и использование полученных результатов для коррекции диеты, образа жизни и режима сахароснижающей терапии.
Медикаментозное лечение
Показания к стандартной терапии ИБС с использованием нитратов, b-адреноблокаторов (БАБ), антагонистов кальция, антитромбоцитарных агентов (ацетилсалициловая кислота) и реваскуляризации миокарда являются одинаковыми у больных СД и без него.
Для улучшения прогноза жизни больного ИБС используются следующие препараты: аспирин (при отсутствии противопоказаний); статины (независимо от исходного уровня холестерина); ингибиторы ангиотензинпревращающего фермента (АПФ) – в тех случаях, если у пациента имеется АГ, сердечная недостаточность, перенесенный инфаркт миокарда или признаки нарушений функции левого желудочка, а также БАБ в тех случаях, если больной перенес инфаркт миокарда и у него имеется сердечная недостаточность.
Основными причинами ограничения использования БАБ при СД считали то, что они оказывают негативное влияние на гликемический профиль, увеличивают риск гипогликемии и маскируют ее проявления. Указанные нежелательные явления в основном характерны для неселективных БАБ (пропранолол и др.), которые увеличивают инсулинорезистентность в связи с уменьшением секреции инсулина, опосредуемой через β2-рецепторы, и уменьшают периферический инсулинозависимый захват глюкозы.
Высокоселективные БАБ (бисопролол и др.) лишены этих побочных эффектов и не оказывают негативных эффектов ни на чувствительность к инсулину, ни на метаболизм глюкозы. В этих случаях у пациентов с СД не наблюдается гипогликемии и не требуется коррекции дозы пероральных сахароснижающих препаратов.
Учитывая риск развития при СД опасной для сердечно-сосудистой системы гипогликемии (особенно при сопутствующей инсулинотерапии и приеме неселективных БАБ), применение БАБ при СД имеет свои особенности. Так, препаратами первого выбора являются селективные БАБ (бисопролол, метопролол, небиволол и др.), воздействие которых на гликемию значительно менее выражено, чем у неселективных препаратов.
Снижение кардиальной смертности составляло 42% между двумя выделенными группами пациентов (4,9 против 8,4%, р < 0,005). Трехлетние кривые выживаемости показали значительное различие в смертности пациентов в двух группах (р = 0,0001).
Результаты многофакторного анализа подтвердили, что прием БАБ является независимым фактором улучшения выживаемости (относительный риск = 0,58; 90%-ный доверительный интервал от 0,46 до 0,74). Среди популяции больных СД наилучший эффект лечения БАБ наблюдался у пожилых пациентов (в возрасте 65 лет и старше), у перенесших в анамнезе инфаркт миокарда, имеющих ограниченные функциональные возможности выполнения нагрузок и имевших низкий риск. Таким образом, терапия БАБ улучшает долгосрочную выживаемость у пациентов с СД и ИБС, относящихся к высокому риску.
В работе Chen J. и соавт. на большой группе пожилых больных (n = 45,308) в возрасте 65 лет и старше, перенесших инфаркт миокарда и не имевших противопоказаний к назначению БАБ, применение этой группы препаратов с целью вторичной профилактики инфаркта миокарда привело к снижению одногодичной смертности у больных СД (подобно пациентам без диабета) и не сопровождалось увеличением осложнений диабета.
При назначении БАБ больным СД следует отдавать предпочтение препаратам кардиоселективного действия, которые можно назначать 1 раз в день, таким как бисопролол фумарат (Конкор, Takeda), т. е. современным селективным БАБ, отличающимся хорошей переносимостью, доказанной высокой эффективностью и достаточной безопасностью у больных ИБС.
Благодаря высокой селективности бисопролол обладает хорошей переносимостью даже у пациентов с относительными противопоказаниями к его назначению и редко вызывает побочные эффекты. Бисопролол (Конкор) практически не оказывает влияния на гладкую мускулатуру бронхов, периферических артерий, углеводный и липидный обмен.
Бисопролол эффективен и безопасен при диабете, он не влияет на уровень глюкозы крови у больных СД, не требуется коррекции дозы при приеме пероральных антидиабетических препаратов.
В исследовании, проведенном в Институте кардиологии им. А.Л. Мясникова РКНПК, у 30 больных АГ I или II степени и метаболическим синдромом назначали бисопролол (Конкор) в дозе 5 мг/сут. Монотерапия бисопрололом в течение 3 месяцев приводила к достоверному снижению минимального систолического и диастолического АД в ночное время и не вызывала достоверной динамики показателей глюкозы плазмы натощак и ее постпрандиального уровня. Метаболически нейтральное действие бисопролола позволяет рекомендовать его больным с сопутствующими нарушениями углеводного и липидного обмена.
В другом исследовании терапия бисопрололом у 49 пациентов в течение 12 месяцев не ухудшала течение СД 2, не приводила к нарастанию инсулинорезистентности и не требовала усиления сахароснижающей терапии даже у больных с клинически выраженной ХСН II–III функциональных классов по NYHА.
Назначение бисопролола может существенно улучшить прогноз жизни больных ИБС с СД, которым выполняются те или иные операции на сердце и сосудах. Так, было показано, что назначение бисопролола во время и после операций АКШ достоверно уменьшало вероятность смерти от любых причин и вероятность нефатального инфаркта миокарда у тех больных, которые имели высокий риск сердечно-сосудистых осложнений. Кроме того, лечение бисопрололом сопровождается снижением заболеваемости, улучшением общего состояния больных, снижением летальности.
Таким образом, при применении бисопролола (Конкора) улучшение общего состояния больных, высокая безопасность лечения характерны для пациентов высокого риска, к которым относятся больные с сочетанием ИБС и СД. Препарат бисопролол включен в Федеральную программу льготного лекарственного обеспечения больных в РФ.
В терапии больных СД, особенно при сопутствующем атеросклеротическом поражении артерий нижних конечностей, также успешно применяется неселективный БАБ с α-блокирующей активностью карведилол. Благодаря блокаде b-1-рецепторов препарат, помимо сосудорасширяющего действия, повышает чувствительность тканей к инсулину. Следует отметить, что больные ИБС с СД особенно склонны к развитию недостаточности кровообращения. Показано, что у этой группы больных препаратами первой линии являются бисопролол, метопролол и карведилол.
Антагонисты кальция (верапамил, дилтиазем, амлодипин) эффективно снижают уровни АД и вместе с тем риск нежелательных сердечно-сосудистых событий у больных СД. Эти препараты не влияют негативно на показатели углеводного и липидного обмена.
В открытом многоцентровом исследовании TRIMPOL-1 (Trimetazidin in Poland) у 50 пациентов со стабильной стенокардией и СД 2 оценивали эффективность и переносимость комбинации триметазидина и антиангинальных препаратов (пролонгированные нитраты, антагонисты кальция).
На фоне приема триметазидина (60 мг/сут) в течение 4 недель достоверно улучшались клинические показатели: частота приступов стенокардии, потребность в нитроглицерине, толерантность к физической нагрузке по данным нагрузочной ЭКГ-пробы на тредмиле. При необходимости усиления антиангинальной терапии пациентам, получающим БАБ, целесообразно добавлять триметазидин.
Ингибиторы АПФ показаны пациентам с СД с подтвержденным диагнозом ССЗ [18, 33], также больным СД, сопровождающимся протеинурией и хроническим заболеванием почек, учитывая их доказанное нефропротективное действие. При лечении ингибиторами АПФ отмечается улучшение метаболизма глюкозы вследствие способности препаратов повышать чувствительность периферических тканей к инсулину.
В процессе лечения ингибиторами АПФ необходимо учитывать, что их назначение больным СД, получающим сахароснижающую терапию, может увеличить риск гипогликемических состояний.
Сочетание СД и нелеченной АГ является наиболее неблагоприятным фактором развития ИБС, инсульта, сердечной и почечной недостаточности. Рекомендуемый уровень АД у больных СД составляет <130/80 мм рт. ст. Для достижения целевого уровня АД при СД обычно требуется комбинированное применение различных групп гипотензивных препаратов, в первую очередь средств, относящихся к ингибиторам ренин-ангиотензиновой системы.
У лиц, страдающих СД, помимо гипергликемии, присутствуют дополнительные ФР развития неблагоприятных исходов ИБС. СД 2, как правило, сопровождается выраженными нарушениями липидного обмена. Для СД наиболее характерна гипертриглицеридемия, которая также сочетается с низким уровнем холестерина липопротеинов высокой плотности (ХС-ЛВП) и преобладанием мелких, плотных, легко окисляющихся частиц холестерина липопротеинов низкой плотности (ХС-ЛНП).
Эти изменения способствуют развитию атеросклероза. Более того, в сочетании с другими ФР, такими как инсулинорезистентность, гипергликемия, АГ и абдоминальное ожирение, они способствуют патологическим изменениям в микроциркуляторном русле, вызывая осложнения, типичные для диабета, ─ диабетическую ретинопатию, нейропатию, поражение артерий нижних конечностей.
Лечение дислипидемии у пациентов с СД следует осуществлять в соответствии с теми же принципами, как у больных с ИБС: приоритетной задачей является достижение целевого уровня ХС-ЛНП, а среди препаратов, которые могут быть использованы для его снижения, ингибиторы ГМГ-КоА-редуктазы (статины) являются препаратами первого выбора.
При выборе конкретного статина необходимо руководствоваться прежде всего данными доказательной медицины и учитывать долговременную безопасность лечения. В этом отношении наилучшие показатели отмечены у аторвастатина и розувастатина. Аторвастатин обладает высокой гипохолестеринемической активностью и существенно снижает уровень триглицеридов.
Всем больным СД 1 с наличием микроальбуминурии и хронической болезни почек рекомендуется снижение уровня ХС-ЛНП (минимум на 30%) путем назначения статинов в качестве средства выбора (в некоторых случаях показана комбинированная терапия), независимо от исходной концентрации ХС-ЛНП. У больных СД 2 в сочетании с ССЗ или хроническим заболеванием почек в возрасте старше 40 лет целевой уровень ХС-ЛНП должен быть <1,8 ммоль/л, а если признаки ССЗ отсутствуют, то уровень ХС-ЛНП должен быть менее 2,5 ммоль/л.
Принимая во внимание, что снижение концентрации глюкозы в крови может лишь незначительно снизить концентрацию ХС-ЛНП, у больных с декомпенсированным СД типа и высоким уровнем в крови ХС-ЛНП необходимо сразу же проводить как сахароснижающую терапию, так и лечение статинами.
На сердечно-сосудистый риск способны повлиять и другие эффекты статинов – противовоспалительный, антиагрегантный и антиоксидантный, которые не зависят от их гипохолестеринемического действия.
Если ориентироваться только на уровень глюкозы натощак, то у 1/3 больных СД может быть не диагностирован. Поэтому ранние стадии гипергликемии и бессимптомно протекающий СД лучше всего диагностировать с помощью перорального глюкозотолерантного теста (прием 75 г глюкозы), дающего представление как об уровне глюкозы натощак, так и через 2 часа после нагрузки.
Недавно получены сведения о том, что риск развития СД (увеличение сахара в крови и гликозилированного гемоглобина (HbA1c) увеличивается на фоне терапии статинами (особенно при назначении больших доз). С одной стороны, исследование группы СТТ (Cholesterol Treatment Trilists Collaboration) показало, что больные СД, принимающие статины, живут дольше, т. к. у них зарегистрировано снижение смертности в среднем на 10%.
С другой стороны, имеются данные, согласно которым при длительном лечении статинами в течение 5 лет в среднем на 9% повышается риск развития гипергликемии. Хотя этот риск ничтожно мал и неясно, развивается ли гипергликемия натощак действительно при СД, тем не менее с 2011 г. соответствующее предупреждение внесено в инструкцию по медицинскому применению розувастатина.
Во всех научных публикациях подчеркивается, что такой эффект существует, но на сегодняшний день это не должно влиять на тактику лечения. Поэтому больные СД и больные с метаболическим синдромом должны получать статины именно потому, что снижение смертности от ССЗ многократно превышает возможный риск, связанный с гипергликемией. В этих случаях абсолютное снижение риска развития сердечно-сосудистой патологии перевешивает незначительное повышение частоты развития С.
При отсутствии адекватного эффекта от назначения статинов у больных ИБС с СД может назначаться комбинированная терапия с присоединением к статинам эзетимиба (секвестранта желчных кислот), никотиновой кислоты пролонгированного действия или фибратов. Фибраты могут применяться в качестве дополнительной терапии в ситуациях, когда с помощью монотерапии статинами не удается в должной мере контролировать уровень триглицеридов и ХС-ЛВП.
Уменьшение уровня триглицеридов у больных СД 2 следует начинать с контроля гликемии. Важным является снижение веса, уменьшение потребления алкоголя и назначение фибратов. Основными преимуществами комбинированной терапии являются: возможность воздействовать на несколько звеньев метаболизма липидов, избегать высоких доз статинов, снизить частоту побочных эффектов, встречающихся при назначении высоких доз препаратов.
Реваскуляризация миокарда
Среди пациентов с ИБС увеличивается доля больных СД, многим из которых проводится реваскуляризация миокарда. При сопутствующем СД обычно наблюдается распространенное поражение коронарных артерий, поэтому приходится шунтировать несколько сосудов. У больных ИБС с СД риск неблагоприятных исходов, в т. ч. смерти, выше, чем у пациентов без СД, независимо от стратегии лечения.
Кроме того, у них отмечаются дополнительные проблемы, такие как более высокий риск рестеноза и окклюзии после чрескожного коронарного вмешательства (ЧКВ) и коронарного шунтирования (КШ). Сравнение достоинств ЧКВ и КШ у этой группы больных проведено в несколько крупных рандомизированных исследованиях.
Затем пациентов рандомизировали и у одной группы проводили только оптимальную медикаментозную терапию (ОМТ), а у другой – также реваскуляризацию миокарда на фоне ОМТ. На этапе скрининга были обследованы 4 623 пациента, примерно 50% из них были включены в исследование. В течение 5 лет наблюдения суммарная частота смерти, ИМ и инсульта у пациентов, получавших консервативное лечение (12,2%) или перенесших реваскуляризацию миокарда (11,7%), существенно не различалась.
В выборке пациентов, которым проводилось ЧКВ, исходы инвазивного и неинвазивного лечения (ОМТ) не различались. В подгруппе пациентов, которым выполняли КШ, выживаемость без сердечно-сосудистых осложнений после хирургического лечения была достоверно выше (77,6%), чем на фоне медикаментозной терапии (69,5%, р = 0,01), однако выживаемость между группами достоверно не различалась (86,4 и 83,6%, р = 0,33).
Во всех рандомизированных клинических исследованиях (РКИ) у больных СД частота повторной реваскуляризации после ЧКВ (независимо от типа стента – с лекарственным покрытием или непокрытый стент) была выше, чем после КШ.
Результаты метаанализа 10 РКИ, в которых изучалась эффективность плановой реваскуляризации миокарда, подтвердили преимущества КШ перед ЧКВ у больных СД с точки зрения улучшения выживаемости. Пятилетняя смертность составила 20% после ЧКВ и 12,3% после КШ (относительный риск 0,70; 95%-ный доверительный интервал 0,56–0,87), в то время как среди пациентов без диабета смертность при этих вмешательствах не различалась. Таким образом, связь между наличием СД и типом реваскуляризации была статистически значимой.
К сожалению, из-за хронического течения метаболических нарушений у больных СД наблюдается постоянное прогрессирование атеросклероза, которое приводит к распространенной ишемии миокарда на фоне поражения нескольких коронарных артерий и определяет высокую частоту рестенозов.
В РФ были проанализированы периоперационные данные 225 пациентов, перенесших КШ в отделе сердечно-сосудистой хирургии ИКК им. А.Л. Мясникова с мая 2004 г. по декабрь 2006 г. Больные СД 2 (n = 125) получали до операции медикаментозную терапию (гипогликемические препараты или инсулин). В группу контроля были отобраны пациенты без СД (n = 114).
В этом исследовании при применении пероральных антитромбоцитарных препаратов в высоких дозах рутинное добавление блокаторов гликопротеиновых IIb/IIIa-рецепторов у больных СД не вызывало дополнительной пользы. Даже после успешной реваскуляризации необходим адекватный контроль сердечно-сосудистых ФР и жесткий контроль гликемии.
В дальнейших исследованиях те же авторы показали, что заболеваемость и смертность от ИБС среди больных с сочетанием ИБС и СД были выше, чем у больных без диабета. В группе больных ИБС с СД по сравнению с больными ИБС без диабета отмечался более выраженный кальциноз коронарных артерий, чаще встречались диффузные и дистальные поражения, а также более тяжелый атероматоз аорты, флебопатии и чаще возникали инфекционные осложнения [29].
Прогноз
Течение заболевания у пациентов с ИБС в сочетании с СД имеет ряд особенностей.
- Риск развития ИБС у больных СД повышен в 3–5 раз, течение ИБС на фоне СД зависит в большей степени от длительности, чем от тяжести СД.
- Осложнения ИБС развиваются на фоне СД раньше, чем при его отсутствии; к 50-летнему возрасту у 40–50% больных СД возникает по меньшей мере одно из сердечно-сосудистых осложнений.
- ИБС на фоне СД во многих случаях протекает бессимптомно как безболевая ишемия миокарда вплоть до безболевых ИМ.
- ИБС на фоне СД нередко осложняется нестабильной стенокардией, ИМ, угрожающими жизни нарушениями сердечного ритма.
- При ИБС на фоне СД быстрее развивается застойная сердечная недостаточность, в т. ч. после ИМ.
- При ИБС у больных СД часто диагностируется диффузное поражение коронарных артерий, включая дистальные участки коронарного русла, что затрудняет проведение ЧКВ и коронарного шунтирования.
- По данным внутрисосудистого ультразвукового исследования, у пациентов с ИБС с диабетом в коронарных сосудах наблюдаются более выраженные атеросклеротические поражения и неадекватное компенсаторное ремоделирование. Ускоренное прогрессирование бляшки, несмотря на медикаментозную терапию, диктует необходимость агрессивной антиатеросклеротической стратегии применения статинов у пациентов с СД.
Большинство больных СД погибают от сердечно-сосудистых осложнений, которые занимают ведущее место среди причин смерти. Сочетание СД и ИБС неблагоприятно с точки зрения прогноза, особенно при неконтролируемой гипергликемии.
Важное значение при этой сочетанной патологии имеют немедикаментозные профилактические мероприятия:
- борьба с ожирением, малоподвижным образом жизни,
- отказ от курения,
- соблюдение диеты (существенное ограничение быстроусвояемых углеводов, а также животных жиров, холестерина),
- соблюдение адекватного стиля жизни.
Источник: http://www.remedium.ru
Принципы патогенетической терапии
В настоящее время можно говорить о пандемии СД, так как, по данным Международной диабетической федерации, около 285 млн человек в мире страдают СД преимущественно 2-го типа. В соответствии с прогнозом специалистов количество больных с этой патологией к 2030 году превысит 435 млн человек.
Следующим неблагоприятным фактом этой категории больных является уменьшение ожидаемой продолжительности жизни. У мужчин с СД 2-го типа в 3 раза выше абсолютный риск сердечно-сосудистой смертности по сравнению с мужчинами без диабета (169 по сравнению с 53 на 10 000 человеко-лет, р < 0,0001) даже после контроля возраста, уровня холестерина, артериального давления и курения.
Наиболее частой причиной смерти больных с СД является ИБС, что было обнаружено в когорте американской популяции при наблюдении с 1971 по 1993 год.
Больные с СД и наличием ИБС имеют более тяжелое клиническое течение и плохой прогноз, особенно при развитии острого коронарного синдрома как с подъемом S-T, так и без подъема S-Т. Результаты Фремингемского исследования документируют более высокую смертность и частоту повторных инфарктов и сердечной недостаточности у больных с СД в острый период инфаркта миокарда и постинфарктный период.
Все эти механизмы формируют атерогенную направленность СД. Сосудистая дисфункция является специфическим спутником СД, проявляется повреждением эндотелия в результате гипергликемии, артериальной гипертензии (АГ), инсулинорезистентности, диабетической дислипидемии, которые оказывают токсический эффект на эндотелий. Таким образом, эндотелиальная дисфункция — это основа для развития как микро-, так и макрососудистых осложнений при СД.
В настоящее время господствует теория патогенеза атеросклероза, в которой центральное место отводится эндотелиальной дисфункции как начальному этапу атерогенеза в ответ на повреждение сосудистой стенки, запускающему ряд специфических клеточных и молекулярных изменений.
Ухудшение функции эндотелия — это не только предиктор становления атеросклероза, но и признак ранних стадий СД. Больные с СД 2-го типа, их родственники первой линии родства и лица с нарушенной толерантностью к глюкозе имеют повышенный уровень циркулирующих маркеров эндотелиальной дисфункции — эндотелина и фактора Виллебранда.
Ранние проявления эндотелиальной дисфункции выражаются в нарушении эндотелийзависимой вазодилатации, в регуляции которой важную роль играет система оксида азота (NO), характеризующаяся у больных CД сниженной продукцией NO, накоплением реактивных метаболитов пероксидации с образованием токсических продуктов.
Гипергликемия через оксидантный стресс, синтез диацилглицерола, а также путем стимуляции продукции конечных продуктов гликолиза активирует протеинкиназу С, которая ассоциируется с аномалиями ряда клеточных функций, включая вазоконстрикцию и эндотелиальную дисфункцию.
В связи с внедрением неинвазивных методов оценки функции эндотелия — плетизмографии, допплер-эхокардиографии, в условиях проведения специфических тестов удалось установить нарушение эндотелийзависимой вазодилатации и эндотелийзависимой констрикции у больных с СД 1-го типа.
Более того, установлено, что лица с нарушениями толерантности к глюкозе и родственники больных с СД 2-го типа имели недостаточный ответ на ацетилхолин путем оценки диаметра плечевой артерии, измеренной методом допплер-эхокардиографии.
У больных СД активация воспалительных процессов обусловлена системными этиологическими факторами, такими как центральное ожирение и инсулинорезистентность. Коморбидные состояния — артериальная гипертензия и дислипидемия, наряду с гипергликемией, провоцируют патофизиологический каскад, генерирующий иммуновоспаление.
Индуцированные воспалительные медиаторы стимулируют рецепторы и факторы транскрипции, что сопровождается апоптозом β-клеток поджелудочной железы, ухудшением сигнальных путей проведения инсулина и снижением чувствительности тканей на периферии.
Ранним признаком воспаления является высвобождение хемокинов, которые увеличивают экспрессию интерстициальных и сосудистых молекул адгезии, что, в свою очередь, вызывает активацию генов, продуцирующих провоспалительные цитокины — фактор некроза опухолей, интерлейкин-1, 6, 18, интерферон и другие.
Метаболические детерминанты сахарного диабета увеличивают риск тромботических осложнений. У больных установлено повышение адгезивных и агрегационных свойств тромбоцитов, при этом отмечается тесная связь этих изменений с дислипидемией.
Более того, большой процент тромбоцитов циркулирует в активированном состоянии, что может быть обусловлено повышенной продукцией маркера оксидантного стресса F2-изопростана в результате гипергликемии.
С учетом многочисленных макро- и микрососудистых осложнений СД 2-го типа, ранней акселерации атеросклероза с формированием клинических проявлений поражения различных сосудистых бассейнов, наличия диабетической дислипидемии это заболевание следует признать не только эндокринной, но и сердечно-сосудистой патологией, поэтому вполне правомочно появление термина «сердечно-сосудистая диабетология».
В соответствии с протоколом оказания медицинской помощи больные с ИБС должны получать комплексную терапию с использованием аспирина, бета-адреноблокаторов, нитратов, блокаторов кальциевых каналов, статинов. В зависимости от клинических проявлений ИБС спектр лечебных мероприятий расширяется.
В связи с этим требованием достаточно много дискуссионных ситуаций возникло в отношении бета-адреноблокаторов, что нашло отражение в формулировке «…рекомендуются всем больным ИБС при отсутствии противопоказаний». Почему возникло именно такое дополнение в данной рекомендации? Необходимо обратиться к истории создания этих препаратов и опыту изучения их фармакологических свойств.
Внедрение в клиническую практику бета-адреноблокаторов в начале 60-х годов ХХ века ознаменовало собой старт новой эры в лечении сердечно-сосудистых заболеваний. Многие годы эти препараты применяются для лечения ИБС, артериальной гипертензии благодаря их антиишемической, антиаритмической и антигипертензивной эффективности.
Несмотря на достаточно убедительный опыт, подтвержденный как клиническими, так и экспериментальными данными, к этой группе препаратов приковано пристальное внимание специалистов. В 2000 году опубликована статья J.M. Chruickshank под интригующим названием «Бета-блокаторы продолжают нас удивлять».
По мнению автора публикации, информация о бета-адреноблокаторах, которая нас «удивляет», состоит в следующем:
- значительное снижение смертности при сердечной недостаточности ишемического и неишемического генеза у больных, получавших эти препараты, и эти эффекты обусловлены селективной блокадой β1-адренорецепторов;
- селективная β1-адреноблокада так же эффективна, как блокада АПФ в снижении заболеваемости и смертности у больных СД 2-го типа с артериальной гипертензией, что было показано в исследовании UKPDS 39. Пациенты в группе атенолола имели более высокие значения гликолизированного гемоглобина в сравнении с группой каптоприла в первые 4 года наблюдения, в последние 4 года наблюдения не было различий в гликемическом контроле и сердечно-сосудистых исходах;
- вызывают интерес наблюдения в исследовании SOLVD, которые показали, что бета-блокаторы в отличие от эналаприла оказывали ренопротективный эффект как в группе плацебо, так и в группе иАПФ;
- не столь интригующими, но достаточно важными следует считать результаты исследования, которые показали значительное снижение оперативной смертности и нефатальных событий после операции на сосудах у больных, получавших бисопролол.
Каким образом можно объяснить дискуссию, которая развернулась в среде ученых и клинических практиков по поводу целесообразности использования бета-адреноблокаторов, при СД в частности?
Прежде всего тем, что использование некоторых препаратов этой группы сопровождается неблагоприятными метаболическими эффектами, в частности повышением гликемии натощак, гликолизированного гемоглобина, уровня триглицеридов, снижением холестерина липопротеидов высокой плотности (ХС ЛПВП).
Однако следует принимать во внимание, что, по результатам рандомизированных клинических исследований, происходит экстраполяция эффектов отдельного препарата на весь класс бета-адреноблокаторов, при этом необходимо учитывать, что эти препараты чрезвычайно гетерогенны фармакологически и обладают контрастными метаболическими эффектами.
Имеющиеся в настоящее время бета-адреноблокаторы различаются по избирательности связывания β-рецепторов (неселективные β1-, β2-адреноблокаторы и селективные β1-адреноблокаторы), наличию внутренней симпатомиметической активности.
Некоторые бета-адреноблокаторы оказывают вазодилатирующий эффект в результате дополнительной блокады α1-адренорецепторов (карведилол, лабетолол) или стимуляции β2-рецепторов (целипролол). Небиволол — высокоселективный липофильный антагонист β1-адренорецепторов с сосудорасширяющими свойствами, опосредованными активацией пути L-аргинин/оксид азота.
Характерно, что бета-адреноблокаторы имеют внутриклассовые различия, определяющие воздействие на состояние инсулинорезистентности. Так, установлено, что повышают чувствительность к инсулину: целипролол на 35 %, карведилол на 13 %; уменьшают чувствительность к инсулину: метопролол на 21 %, атенолол на 22 %, пропранолол на 33 %. Таким образом, бета-адреноблокаторы третьей генерации (карведилол) снижают инсулинорезистентность, в то время как «старые» препараты (пропранолол, атенолол, метопролол) повышают.
В рекомендациях Европейского общества по лечению артериальной гипертензии (2007) подчеркивается, что для лечения больных с метаболическим синдромом рекомендуются бета-адреноблокаторы: карведилол и небиволол. Выбор этих препаратов обусловлен их метаболической нейтральностью по отношению к метаболизму углеводов и липидов, а также возможностью воздействия на патогенетические звенья артериальной гипертензии и ИБС.
Особенностью небиволола является его способность восстанавливать эндотелиальную дисфункцию.
J.M. Ritter и соавт. отметили повышение активности эндотелиальной синтазы после курса лечения небивололом.
L.Van Bortel выявил, что в эндотелиальных и гладкомышечных клетках аорты и коронарных артерий человека небиволол повышает выработку оксида азота и снижает выработку эндотелина.
C. Napoli и соавт. исследовали концентрации нитратов в плазме и моче под влиянием лечения небивололом и пришли к выводу, что небиволол улучшает функцию эндотелия и замедляет атерогенез у больных артериальной гипертензией.
Целью нашего исследования была оценка функционального состояния эндотелия методом допплер-эхокардиографии у больных артериальной гипертензией и ожирением под влиянием лечения небивололом. Больным проводили тест Целемайера — Соренсена для изучения эндотелийзависимой и эндотелийнезависимой вазодилатации.
Через 1 месяц после лечения небивололом у 60 % больных отмечалось восстановление просвета сосудов до 7–10 минут, у 26,8 % — прирост диаметра до ∆0,28 %. Показатели средней скорости кровотока у 86,6 % больных восстановились до 7–10 минут. С учетом полученных данных был сделан вывод о том, что терапия небивололом положительно влияет на эндотелий сосудов.
Одним из эффектов высокого уровня норадреналина является стимуляция бета1-рецепторов, что приводит к некрозу кардиомиоцитов и повреждению стенки коронарных артерий, где преобладают бета1-адренорецепторы. Стимуляция бета1-адренорецепторов также сопровождается усиленной продукцией ренина в юкстагломерулярном аппарате почек, стимулируя увеличенную продукцию ангиотензина II, что приводит к АГ, повышению внутригломерулярного давления и риску развития нефропатии.
Ангиотензин II, в свою очередь, индуцирует высвобождение норадреналина, и таким образом замыкается порочный круг. Этот цикл может быть прерван блокадой бета1-рецепторов, тем самым снижаются или элимируются побочные эффекты. Эти положения явились обоснованием для назначения селективных бета1-адренорецепторов для лечения ИБС у больных СД 2-го типа.
Использование селективных бета1-адреноблокаторов позволяет противодействовать неблагоприятным изменениям обмена липидов. Благоприятные эффекты бета-селективной блокады получили убедительную доказательную базу при применении препарата бисопролол, селективность которого достаточно высокая.
Следовательно, в комплекс средств по вторичной профилактике васкулопатий у больных СД целесообразно включать статины, что обусловлено их возможностью оказывать не только гиполипидемический эффект, но и плейотропные эффекты: улучшение эндотелиальной функции, подавление воспаления, способность стабилизировать атеросклеротическую бляшку и уменьшать ее готовность к разрыву.
Специальных трайлов по оценке эффективности статинов у больных СД не было проведено, однако эти больные были выделены в качестве специальных дополнительных подгрупп при обследовании больных с кардио- и цереброваскулярной патологией.
Среди наиболее известных подобного рода исследований следует отметить: 4S (Scandinavian Simvastatin Survival Study, 1994) — больные, которые перенесли инфаркт миокарда и/или наличие стенокардии и СД; HPS (Heart Protection Study) — больные с ИБС и СД; PROVE-IT (Pravastatin or Atorvastatin Evaluation and Infection Therapy) — больные с острым коронарным синдромом и СД; TNT (Treating to New Target) — больные после инфаркта миокарда, стентирования, шунтирования. В исследование CARDS были включены больные с СД и факторами риска сердечно-сосудистых заболеваний — артериальной гипертензией, ретинопатией, протеинурией, курением.
Во всех этих исследованиях показано, что добавление статинов к стандартной терапии уменьшает риск сердечно-сосудистых и цереброваскулярных событий.
В рекомендациях ESC и EASD разработана стратегия первичной и вторичной профилактики ИБС у больных СД, основанная на терапевтической коррекции дислипидемии, прежде всего статинами, для улучшения прогноза заболевания. Наиболее перспективными представляются такие положения:
- назначение статинов с целью первичной профилактики, независимо от уровня ХС ЛПНП, для уменьшения его уровня на 30–40 % ниже исходного;
- у больных СД с гипертриглицеридемией свыше 2 ммоль/л, которая сохраняется после достижения целевого уровня ХС ЛПНП с помощью статинов, терапия последними должна быть интенсифицирована;
- если у пациентов с СД на максимальной дозе статинов целевой уровень ХС ЛПНП (1,8 ммоль/л) не достигается, то к лечению необходимо добавить ингибитор всасывания холестерина — эзетимиб. В некоторых клинических ситуациях целесообразно рассмотреть возможность комбинированной терапии статинами с никотиновой кислотой или фибратами.
Фибраты могут также выступать в качестве альтернативного варианта терапии у пациентов с атерогенным профилем, типичным для СД, который характеризуется повышенным уровнем триглицеридов, сниженным ХС ЛПВП и преобладанием в кровотоке маленьких плотных частиц ЛПНП.
Результаты расширенных испытаний фибратов (BIP — Bezafibrate Infarction Prevention study, HHS — Helsinki Heart Study, VA-Hit — Veterans Affairs High-density lipoprotein cholesterol Intervention Trial, FIELD Intervention and Event Lowering in Diabetes) подтверждают гипотезу, что применение фибратов у пациентов с инсулинорезистентностью и СД 2-го типа с метаболическим синдромом может быть достаточно эффективным.
В настоящее время применение статинов в качестве монотерапии даже в оптимальных дозах и при достижении целевых уровней ХС ЛПНП все еще является недостаточно эффективным у пациентов со смешанным атерогенным профилем дислипидемии при высоком риске коронарных событий.
Комбинированная гиполипидемическая терапия, которая включает статины и фибраты, признана целесообразной для коррекции дислипидемии при метаболическом синдроме и СД, так как имеет преимущества для достижения целевого уровня липидных фракций, так как статины контролируют уровень ХС ЛПНП, в то время как уровень ХС ЛПВП и триглицеридов нормализуется фибратами.
Таким образом, лечение ИБС, сочетанной с сахарным диабетом, требует дифференцированного подхода, использования препаратов патогенетической направленности, улучшающих метаболический профиль.
Источник: http://www.mif-ua.com
Поражение сердца при сахарном диабете
Проблема поражений сердца при сахарном диабете (СД) остается актуальной, так как основной причиной нетрудоспособности и смертности у больных СД остается ишемическая болезнь сердца (ИБС) и другие сердечно-сосудистые осложнения. В основе развития сердечно-сосудистой патологии лежат вторичные метаболические нарушения, возникающие вследствие длительной де- или субкомпенсации СД (гипергликемии). Выделяют 3 основных гистопатологических типа повреждения сердца при СД.
- Диабетическая ангиопатия с поражением артерий (микроангиопатия) и коронарных артерий (макроангиопатия). Преимущественное поражение крупных коронарных артерий выражается в виде атеросклеротических бляшек, тромбозов и является гистоморфологическим признаком различных вариантов течения ИБС.
- Миокардиодистрофия характеризуется возникновением дистрофических изменений миокардиальных волокон и постепенным нарастанием признаков недостаточности миокарда.
Диабетическая вегетативная сердечная нейропатия (ДВСН) проявляется в уменьшении количества нервных волокон, их демиелинизации и дегенеративных изменениях в аксонах и сопровождается клиническими признаками нарушения сердечной проводимости и др.
Эти типы поражения сердца при СД могут развиваться самостоятельно и (или) в сочетании (в любых комбинациях).
Поражение коронарных артерий. Большинство исследователей свидетельствуют о достоверной зависимости роста частоты ИБС при СД. Доказано, что в аналогичных возрастных группах без СД поражение коронарных артерий встречается в 2 раза реже у -мужчин и в 3 раза реже у женщин.
Согласно многочисленным литературным данным, до 75% всех случаев смерти больных с СД обусловлены острой сердечно-сосудистой патологией. Исследования, проведенные в клинике Joslin (США), демонстрируют, что в возрасте 30—55 лет от сердечно-сосудистых заболеваний умирают 35% диабетиков (по сравнению с 8% больных без диабета).
Большинство исследователей отмечают, что ИЗСД способствует более быстрому прогрессированию поражения коронарных артерий, что объясняется исходной дислипидемией, характерной для этой группы больных. Считается, что тип СД не влияет на развитие коронарного атеросклероза. Однако не вызывает сомнений, что декомпенсация СД и ее длительность обусловливают прогрессирование поражений коронарных артерий.
Таким образом, наряду с общепризнанными факторами риска развития и прогрессирования атеросклероза коронарных сосудов СД может быть выделен как очередной и независимый фактор риска этой патологии.
Во-вторых, развивается дислипопротеинемия, сопровождающаяся гипертриглицеридемией и гиперхолестеринемией. В основе этого процесса лежит активация 3-гидрокси-3-метилглютарил-КоА-синтетазы, катализирующей в печени и эндотелиальных клетках процессы биосинтеза холестерина и триглицеридов и усиленное поступление свободных жирных кислот вследствие активации липолиза.
В-третьих, определенную роль играют нарушение внутрисосудистого свертывания крови и склонность к тромбообразованию. Гиперкоагуляционный синдром является следствием изменения соотношения простагландинов тромбоксана А2, В2 в сторону последнего.
Но, несмотря на гипергликемию, для инсулиннезависимого СД (ИНЗСД) характерна гиперинсулинемия, вызывающая повышенное образование антагонистов инсулина, в частности соматотропина. Именно соматотропин стимулирует пролиферацию гладкомышечных клеток и проникновение в них липидов. Кроме того, прогрессированию атеросклероза способствуют курение, артериальная гипертензия, ожирение. Есть данные, что предсказать ИБС можно с помощью выявления микроальбуминурии.
Следовательно, при СД имеется ряд факторов, которые могут способствовать преждевременному возникновению и прогрессированию атеросклероза, и чем больше их выявлено у больного, тем выше угроза заболевания. Но это предположение поддерживается не всеми авторами.
Диагноз ИБС при СД не всегда прост, так как течение болезни часто атипичное. Наиболее распространенной атипичной формой ИБС при СД является “тихое”, безболевое течение болезни, когда отсутствуют типичные стенокардитические боли в анамнезе, а диагноз устанавливается после выявления инфаркта миокарда или внезапной смерти.
При отсутствии характерных клинических симптомов приобретают значимость специальные методы обследования, позволяющие установить ИБС до грозных осложнений. В качестве таких методов могут быть использованы: мониторинг ЭКГ; проба с физической нагрузкой; сцинтиграфия миокарда с таллием-201; предсердная стимуляция; коронароангиография; фармакологические пробы.
Мониторинг ЭКГ (холтер-мониторирование) позволяет зафиксировать признаки ишемии миокарда (смещение сегмента ST, изменение: Т и др.) в момент болевого приступа и вне его. Эта методика не инвазивна, легко переносится пациентами, но требует продолжительного наблюдения и специального оборудования [9, 16]. Значимость мониторинга ЭКГ возрастает при необходимости верификации безболевых приступов ишемии миокарда.
ЭКГ-пробы с дозированными физическими нагрузками (велоэргометрия, тредмил и др.) провоцируют развитие ишемии миокарда в период выполнения физической нагрузки и позволяют ее документировать. Эти тесты также приобретают особую значимость при атипичном и (или) безболевом течении ИБС. Иногда проведение велоэргометрии и других нагрузочных проб затруднено в связи с патологией сосудов ног и дистальной нейропатией.
Кроме того, велоэргометрия противопоказана при прогрессирующей стенокардии, тромбофлебитах, легочно-сердечной недостаточности, артериальной гипертензии свыше 220/130 мм рт. ст.
Чреспищеводная электростимуляция — один из наиболее часто используемых в клинической практике методов предсердной стимуляции. Метод основан на навязывании сердцу ритма сокращений со ступенеобразным увеличением их частоты до 160—170 уд/мин и регистрацией электрокардиографических признаков ишемии миокарда в виде горизонтальной или косонисходящей депрессии сегмента Т на 1 мм и более.
Предсердная стимуляция противопоказана в случае заболеваний пищевода при стабильном течении стенокардии напряжения ФК III—IV, фибрилляции предсердия в момент обследования, недостаточности кровообращения IIб—III ст., аневризме сердца, внутрисердечных тромбах, протезах клапанов, острых инфекционных заболеваниях.
Коронароангиография — инвазивный метод, требующий специального оборудования, который позволяет визуально оценить состояние коронарных артерий: степень, локализацию и распространенность патологического процесса. Учитывая сложности в проведении коронароангиографии, этот метод используется сравнительно редко.
Фармакологические пробы с дипиридамолом и изопротеренолом позволяют документировать скрытые проявления ишемии миокарда при помощи ЭКГ или радионуклидной сцинтиграфии. Эти пробы легко переносятся больными и имеют меньше противопоказаний, чем пробы c физической нагрузкой.
Единичные работы по скринингу ИБС при СД подтверждают скрытое, бессимптомное течение ИБС приблизительно у 50% пациентов. Проведение углубленного обследования позволяет начать лечение, предупредить развитие осложнений ИБС и тем самым снизить смертность больных СД.
Одним из грозных осложнений ИБС является инфаркт миокарда, который при СД увеличивает вероятность летального исхода. Причины летальности при сочетании инфаркта миокарда с СД следующие:
- декомпенсация диабета, сопровождающаяся развитием кетоацидоза, резко ухудшает состояние больного за счет водно-электролитных изменений;
- резкое снижение гликемии (вплоть до гипогликемии) усугубляет ишемию миокарда;
- гиперкоагуляционный синдром приводит к более частым тромбоэмболическим осложнениям;
- чаще развиваются аритмии;
- гипергликемия, сопровождающаяся повышенным образованием гликозилированного гемоглобина, усугубляет тканевую гипоксию.
Диабетическая миокардиодистрофия (ДМ) подразумевает специфические для диабета дистрофические изменения в миокарде за счет длительных метаболических нарушений. ДМ подразделяют на первичную и вторичную. Первичная является результатом накопления в интерстициальной ткани миокарда гликопротеидных комплексов, глюкуронатов и аномального коллагена.
Вторичная развивается вследствие обширного поражения капиллярного русла миокарда микроангиопатическим процессом. Как правило, эти два процесса развиваются параллельно. При гистологическом исследовании обнаруживаются утолщение базальной мембраны капилляров, пролиферация эндотелиальных клеток, микроаневризмы, а также миокардиальный фиброз и дегенеративные изменения мышечных волокон.
Основой восполнения энергетических потребностей миокарда является утилизация свободных жирных кислот и аминокислот. Параллельно отмечается накопление в сердечной мышце триглицеридов, фруктозо-6-фосфата, гликогена и других полисахаридов. Нарушение функции печени в результате развития диабетического гепатоза усугубляет метаболические нарушения в миокарде и ускоряет развитие ДМ.
Поскольку патогенетическая основа ДМ — глубокая декомпенсация СД, она развивается, как правило, у больных ИЗСД с частыми кетоацидозами.
Клинические проявления ДМ обусловлены нарушениями сократительной способности миокарда за счет уменьшения массы миокардиальных клеток. При этом больные отмечают ноющие, разлитые боли в области сердца вне четкой связи с физическими нагрузками. Эти боли, как правило, не имеют характерной для ИБС иррадиации и проходят самостоятельно, без использования коронаролитиков.
Поскольку клинические признаки ДМ весьма неспецифичны, для верификации диагноза используются инструментальные методы: фонокардиография и электрокардиография; эхокардиография; сцинтиграфия миокарда с таллием-201.
Наиболее информативными методами являются эхокардиография и сцинтиграфия, которые позволяют достоверно оценить изменение массы сердца и снижение сократительной способности миокарда. Развитие синдрома гиподинамии сердца сопровождается уменьшением ударного и минутного объема.
Диабетическая вегетативная сердечная нейропатия (ДВСН) верифицируется сравнительно редко, поскольку не имеет характерных и специфических клинических проявлений. Однако следует помнить, что диагностика ДВСН весьма важна, так как эта патология часто ассоциирована со случаями внезапной смерти. Имеющиеся литературные данные не позволяют достоверно говорить о частоте развития ДВСН, хотя есть несомненные доказательства зависимости ДВСН от длительности декомпенсации СД и наличия других нейропатических признаков.
Развитие ДВСН обусловлено нарастанием явлений денервации сердца с вовлечением в патологический процесс сначала парасимпатических, а затем симпатических нервных волокон. Поскольку сердце богато иннервировано, начальные поражения вегетативных нервных волокон не отражаются на сердечной деятельности. Прогрессирование ДВСН сопровождается нарушением моторной функции сердца, сердечной проводимости и чувствительности.
Морфологические изменения при ДВСН характеризуются уменьшением количества нервных волокон, их демиелинизацией, дегенерацией аксонов. Нервные волокна уплотняются, пустеют за счет появления в них вакуолей.
Не вызывает сомнений тот факт, что в патогенезе ДВСН превалируют метаболические нарушения в нервных волокнах, сопровождающиеся накоплением в них сорбитола и гликозилированных белков, которые изменяют структуру нейрона. Кроме того, за счет микроангиопатии параллельно поражаются vasa nervorum, что усугубляет нарушение трофики нервной ткани.
Иногда ранним симптомом ДВСН является ортостатическая гипотония, развивающаяся вследствие симпатической денервации сердца [6, 19]. Ортостатическая гипотония характеризуется снижением артериального давления до 30 мм рт. ст. при перемене положения тела из ортостаза в клиностаз [32]. У больных отмечаются головокружения, потемнение в глазах, резкая слабость, возможны кратковременные потери сознания.
Кроме характерных клинических симптомов для диагностики ДВСН используются функциональные тесты. Основным и общепринятым тестом является регистрация изменений R—R-интервалов на ЭКГ на фоне форсированного дыхания, в положении лежа и после принятия вертикального положения. При этом регистрируется снижение вариабельности R—R-интервалов, что служит показателем выраженности ДВСН.
Поражение сердца при СД может быть изолированным или комбинированным. Для выяснения частоты встречаемости этих поражений требуется активное целенаправленное кардиологическое обследование больных с использованием перечисленных методик для дифференциальной диагностики поражений сердца при СД.
Источник: http://www.mednovosti.by